Uvod (povijesni podatci, krvne grupe, definicija, uzroci i mehanizam nastanka)
Rh senzibilizacija ili izoimunizacija predstavlja patološko stanje imuniziranosti Rh negativne trudnice eritrocitnim antigenima Rh pozitivnog fetusa, koje karakterizira trajno prisustvo anti Rh antitijela u krvotoku trudnice odnosno žene. Rh senzibilizacija sa svojim je kliničkim posljedicama za fetus i novorođenče dugo bila poznata u povijesti kao fetalna eritroblastoza (Schridde 1910) zbog eritroblasta (nezrele forme eritrocita) u fetalnoj perifernoj krvi. Karl Landsteiner i Alexander S. Wiener otkrili su 1937. godine novi eritrocitni antigen koji su zbog sličnosti s antigenima eritrocita Rhesus majmuna nazvali Rhesus ili Rh faktor, a Philip Levine je sa suradnicima 1941. godine razjasnio i objavio etiopatogenezu ovog patološkog stanja koje je sada nazvano fetalnom odnosno neonatalnom hemolitičkom bolesti.
Mehanizam nastanka (etiopatogeneza) poremećaja je sljedeća: sve počinje prijelazom fetalnih eritrocita s Rh antigenima (D, C ili E) u majčin krvotok, no u nastavku je patogeneza pojašnjena na primjeru D antigena odnosno antitijela, koji je sam prisutan u više od 95% slučajeva Rh-senzibilizacije. Prijelaz RhD pozitivne fetalne krvi u krvotok Rh negativne majke, tzv. fetomaternalna transfuzija, odvija se najčešće tijekom poroda, osobito trećeg porodnog doba, ili pobačaja, a puno rjeđe i tijekom same trudnoće. Ne treba zaboraviti na moguće tzv. kasne fetomaternalne transfuzije kod kojih retroplacentarna krv kroz jajovode dospijeva u majčinu trbušnu šupljinu, odakle se resorbira u krvotok. Na taj način, u pravilu, može prijeći do najviše 10mL fetalne krvi. Najviše zahvaljujući uspješnoj profilaksi koja se u svijetu počela provoditi od 1964. godine, a u nas u Rijeci već od 1967. godine, danas je Rh senzibilizacija vrlo rijedak klinički problem s incidencijom od 1-2 slučaja na 1000 poroda.
Fetalni eritrociti s prisutnim RhD antigenom obično opstaju u majčinom krvotoku do 120 dana prije nego što se razgrade. Kako imunološki sustav majke razgrađuje fetalne eritrocite, tako se oslobađa strani RhD antigen koji izaziva aktivaciju B-limfocita u plazma stanice koje će sintetizirati specifična anti D antitijela ili aglutinine. Spomenuti primarni imunološki odgovor rezultira proizvodnjom tzv. kompletnih antitijela iz klase imunoglobulina M (IgM), često u niskim koncentracijama koje se ne mogu odmah dokazati postojećim imunološkim metodama detekcije. Oni posjeduju veliku molekulsku masu od oko 930 kD i ne mogu proći kroz placentarnu membranu, zbog čega u slučajevima primoimunizacije u aktualnoj trudnoći, u pravilu, ne postoji ugroženost ploda od hemolitičkog oštećenja. Međutim, nakon više mjeseci, što praktično znači u sljedećoj trudnoći s RhD pozitivnim plodom, memorijske B stanice senzibiliziranog majčinog organizma u ponovnom kontaktu sa specifičnim (fetalnim) D antigenom brzo se aktiviraju u plazma stanice koje produciraju veće količine anti D antitijela, što je ponekad prvi jasan dokaz postojanja Rh senzibilizacije. Ova antitijela iz klase imunoglobulina G (IgG) su inkompletna antitijela niske molekulske mase od oko 155 kD i zato sposobna, za razliku od IgM antitijela, proći kroz placentarnu membranu i izazvati imunološku reakciju s eritrocitnim antigenima. U fetalnom krvotoku antitijela se fiksiraju na eritrocite i prijevremeno ih razgrađuju (hemoliziraju), većinom u imunokompetentnom tkivu slezene uz pomoć makrofaga. Posljedica je hemolitička bolest odnosno hemolitička anemija, koja se ovisno o opsegu procesa hemolize, može pogoršati do fetalne asfiksije i acidoze koje ugrožavaju život fetusa. Fetus se bori protiv anemije kompenzacijskom ekstramedularnom (izvan koštane srži) proizvodnjom eritrocita, koja se odvija u jetri, slezeni i sluznici crijeva. Posljedice su povećanje jetre i slezene (hepatosplenomegalija) i pojava nezrelih formi eritrocita (eritroblasta) u perifernoj krvi. U slučajevima jače imunološke reakcije i izražene anemije i asfiksije mogu nastati oštećenja krvnih kapilara i generalizirani edemi (fetalni hidrops; lat. hydrops fetalis). Hidropični fetusi životno su ugroženi i mogu umrijeti intrauterino ili u ranom neonatalnom razdoblju usprkos adekvatnoj terapijskoj intervenciji. Rezultat razgradnje fetalnih eritrocita je nakupljanje pretežno indirektnog (nekonjugiranog) bilirubina u fetalnom krvotoku, koji se odvodi u majčinu cirkulaciju i tako prevenira razvoj žutice (lat. icterus). Bilirubin dospijeva i u amnijsku tekućinu, gdje se njegove koncentracije mogu mjeriti, što se u praksi koristi za određivanje jačine hemolize, anemije i stupnja fetalne ugroženosti. Nakon trudnoće, kroz nekoliko sljedećih tjedana ili mjeseci, količina antitijela u krvotoku majke se smanjuje, ponekad ispod razine detekcije i takvom može ostati sve do sljedeće trudnoće.
Osobe s najčešćim krvnim grupama A i O čine 41% odnosno 39% populacije, dok se druge krvne grupe pojavljuju puno rjeđe, B krvna grupa u 15%, a AB u 5% stanovništva. Rh sustav antigena drugi je najvažniji sustav krvnih antigena među nekoliko desetaka do sada poznatih humanih antigenskih sustava. Danas se opisuje oko 50 različitih antigena Rh sustava, ali glavni i klinički najvažniji Rh antigeni su D, C, c, E i e antigen. Mali „d“ samo je hipotetičan odnosno ne postoji, a navedena oznaka indicira odsustvo D antigena, što podrazumijeva da je odgovarajući RHD gen koji kodira njegovu produkciju, „izbrisan“ ili na drugi način nefunkcionalan. Drugi Rh antigeni su vrlo rijetki i još rjeđe klinički značajni. Osobe koje posjeduju RhD antigen su Rh pozitivne, a one koje ga nemaju su jednostavno Rh negativne. Postoji podatak o prosječnom globalnom odnosu 94% prema 6% u korist osoba s RhD antigenom s tendencijom smanjivanja broja Rh negativnih osoba, prvenstveno zbog slabog nataliteta Europljana. Treba naglasiti da se zastupljenost osoba s RhD antigenom značajno razlikuje među pojedinim svjetskim populacijama. Tako npr. u populacijama Velike Britanije, Europe i SAD 83-85% osoba nosi RhD antigen, dok je preostalih 15-17% Rh negativno. Samo su u nekim svjetskim populacijama spomenuti omjeri bitno drugačiji, pa tako u narodu Baska ima čak 36% Rh negativnih osoba, u Aziji, npr. u Indiji, Kini, Japanu, Koreji i Indoneziji, je manje od 1% osoba Rh negativno, dok se u afričkim zemljama postotak Rh negativnih osoba smanjuje od sjevera prema jugu Afrike, od 10% na čak 1%. Zanimljiv je znanstveni podatak da postoje osobe bez antigena Rh sustava, koje se nazivaju Rh null osobe, a njihov fenotip Rh null fenotip. Ovakvo je stanje izvanredno rijetko i do sada su identificirane samo 44 takve osobe na cijelome svijetu (zadnja je pronađena Pakistanka Ranam Rao). Eritrociti bez Rh antigena imaju strukturne membranske abnormalnosti koje mogu rezultirati hemolitičkom anemijom. Do danas je registrirano samo devet aktivnih darivatelja krvi s ovim genetskim poremećajem.
Treba naglasiti da je imunološka reakcija moguća samo kod konstelacije Rh negativna majka – Rh pozitivan plod, a takve se trudnoće nazivaju heterospecifičnim trudnoćama (oko 10% svih trudnoća). Rh senzibilizacija događa se prirodno u oko 5% heterospecifičnih trudnoća.
Nasljeđivanje antigena iz Rh sustava prilično je kompleksno. Genski lokusi za Rh antigene nalaze se na kratkom kraku 1. kromosoma odnosno kromosomskog para. Prema zadnjim istraživanjima na svakom od kromosoma postoje samo dva susjedna genska lokusa s genima odgovornima za kodiranje Rh antigena. Tako RHD gen kodira protein na membrani eritrocita za D antigen. Osobe koje nemaju funkcionalni RHD gen i ne mogu producirati RhD antigen, su Rh negativne osobe. Susjedni višestruko specifični RHCE gen kodira vrlo slične RhCE proteine za sljedeća četiri najčešća Rh antigena C, c, E i e. Geni su međusobno funkcionalno povezani, nasljeđuju se dominantnim načinom, ali je moguća i izmjena gena između kromosoma (engl. crossing over). Istraživanja su pokazala da je RHD gen nastao duplikacijom RHCE gena tijekom evolucije primata. Naknadno je na 6. kromosomu pronađen RHAG gen odgovoran za kodiranje i kontrolu Rh udruženih glikoproteina odnosno RhAG antigena. Tako, polipeptidi odnosno antigeni producirani od RHD i RHCE gena zajedno sa spomenutim Rh udruženim glikoproteinima formiraju Rh antigenski kompleks na površini eritrocita.
Fenotip predstavlja skup naslijeđenih svojstava i obilježja, a genotip ukupan broj gena naslijeđen od roditelja. Rh fenotip koji čine svi površinski Rh antigeni, određuje se serološki pomoću specifičnih antitijela. Većina Rh fenotipova može nastati kod više različitih Rh genotipova. Rh genotip, tj. svi geni Rh sustava neke osobe, može se pouzdano utvrditi DNA metodama molekularne genetike. Od ukupno 36 mogućih Rh genotipskih kombinacija, potvrđeno je njih 28, a preko 90% bijelaca posjeduje samo šest najčešćih genotipova (DCe/dce, DCe/DCe, DCe/DcE, DcE/dce, DcE/DcE, dce/dce).
Antenatalna skrb i klinička procjena fetalne ugroženosti
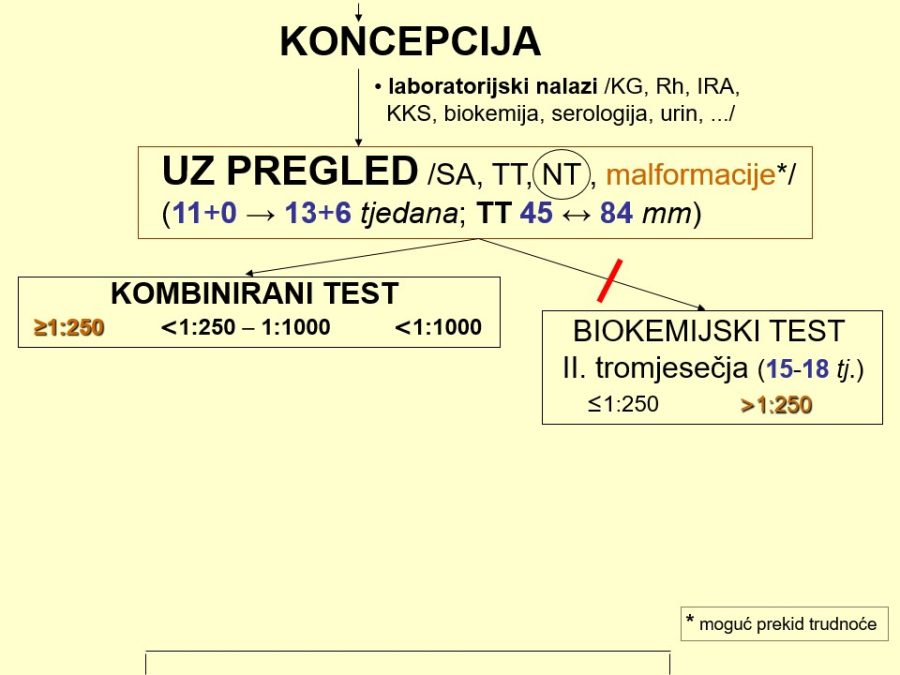
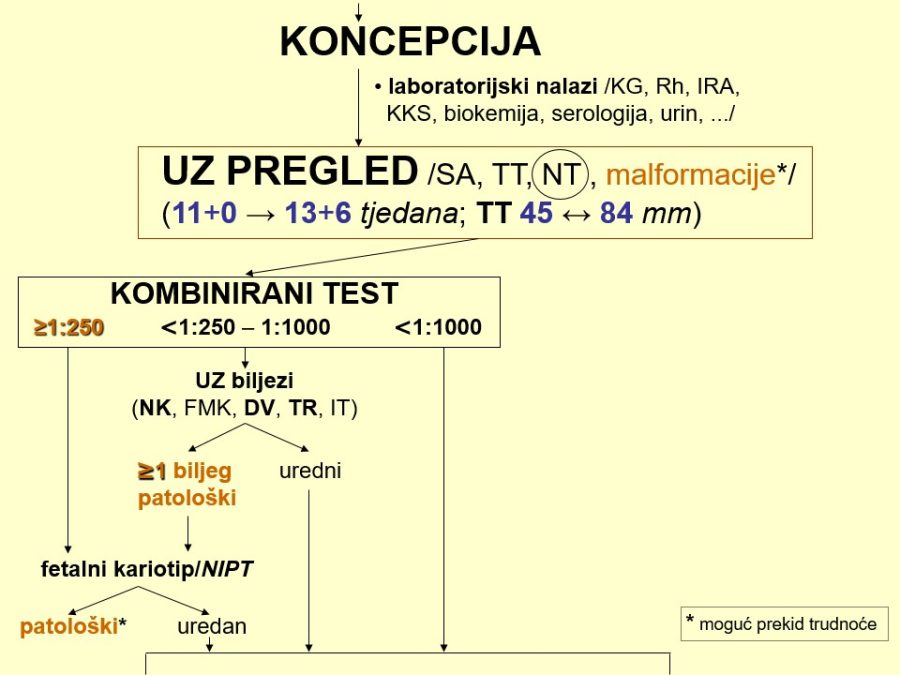
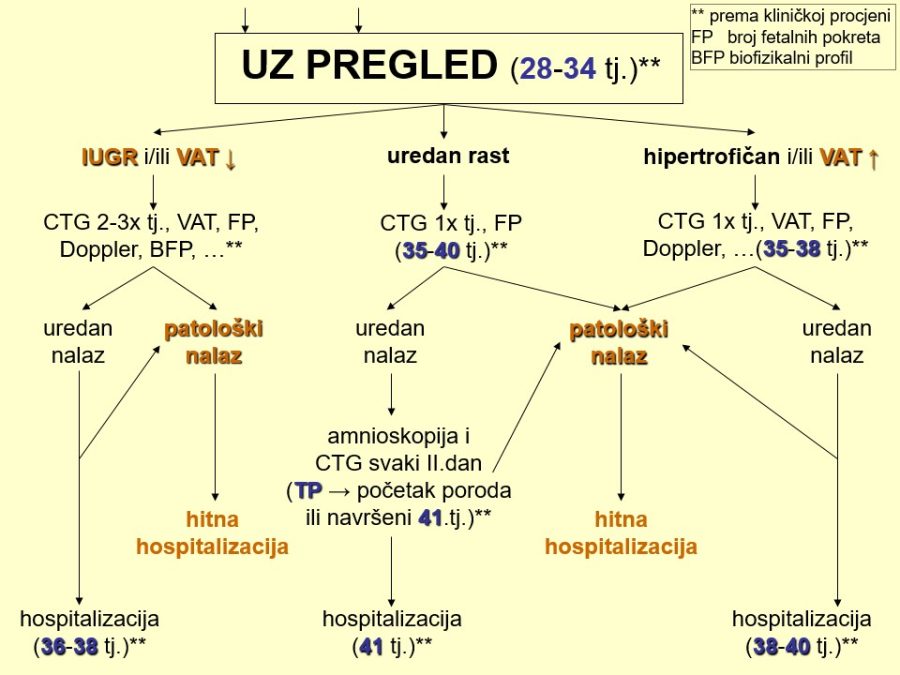
Cilj specifične antenatalne skrbi je izdvojiti Rh negativne trudnice, identificirati one s prisutnim anti Rh(D) antitijelima i laboratorijskim i kliničkim metodama pravovremeno odrediti potencijalnu ugroženost ploda, te spriječiti fetalni / neonatalni mortalitet. Svim trudnicama potrebno je zato odrediti krvnu grupu i Rh faktor. Eventualno prisustvo nepravilnih ili iregularnih antitijela dokazuje se probirnim ili trijažnim postupcima, pomoću nespecifičnih testova, a zatim se otkrivena antitijela trebaju obvezno identificirati serološkim metodama. Opisani dijagnostički pristup predstavlja temelj dijagnostike Rh senzibilizacije, jer omogućuje najprije izdvajanje Rh negativnih trudnica, a zatim identifikaciju onih sa specifičnim anti RhD antitijelima. U slučajevima opterećene reprodukcijske anamneze (mrtvorođenost nejasnoga uzroka, eksangvinotransfuzija, cerebralna oštećenja, …) specifične serološke pretrage treba učiniti već u prvom tromjesečju trudnoće, a najkasnije do 22. tjedna trudnoće. Ne dokažu li se anti RhD antitijela u majke (negativan indirektni Coombs test) kod prvog testiranja, istu pretragu treba ponavljati jednom mjesečno do eventualno pozitivnog nalaza. U slučajevima prvih trudnoća ili trudnoća bez opterećenja u anamnezi, serološku pretragu s negativnim nalazom u prvom tromjesečju dovoljno je ponoviti u 36. tjednu trudnoće. Postupak je dovoljno siguran za praksu, budući eventualna kasna pojava anti RhD antitijela neće ugroziti plod i neće zahtijevati nikakvu prijevremenu opstetričku intervenciju. Za razliku od anti D antitijela, sva ostala anti Rh antitijela reagiraju jače s eritrocitima osoba koje su homozigoti za taj Rh antigen u odnosu na eritrocite heterozigotnih osoba (npr. reakcija anti E antitijela bit će jača na E antigen kod Rh genotipa EE nego kod Ee). Osim toga, identifikacija anti E antitijela u neke osobe jako sugerira istodobno postojanje anti c antitijela zbog već opisanog kombiniranog nasljeđivanja. Zato se osobama s anti E antitijelima uobičajeno daje E negativna i c negativna krv za transfuziju, jer su upravo anti c antitijela čest uzrok odgođene posttransfuzijske hemolitičke reakcije.
Antigeni se inače sastoje od aminokiselina i polisaharida (hapteni) koji su ključni za njihovu specifičnost. Antigenost koju određuje upravo proteinski dio molekule, ovisi o tome koliko je antigen različit odnosno stran (majčinom) organizmu, o veličini i konfiguraciji molekule, te procesima njihove razgradnje i resorpcije u organizmu domaćina. Kad je riječ o složenom Rh antigenu koji se može dokazati već u embrija starih šest tjedana (između 40. i 50. dana embrionalnog razvitka), RhD antigen je najjači imunogen, a zatim slijede antigeni C, c, E i e. Jačina D antigena pojačava se od tzv. low grade ili weak Du i high grade ili partial Du, preko normalnoga D antigena do tzv. strong D antigena. Osim što je najjači, D antigen je i najzastupljeniji od Rh antigena u osoba bijele rase, a slijede ga e antigen (96%), c i C antigen s 80% odnosno 70% i E antigen s 30%. Premda je Rh senzibilizacija moguća s bilo kojim od stranih Rh antigena, u preko 97% slučajeva odgovorni su D antigen i kombinacije s D antigenom.
Klinička procjena ugroženosti RhD pozitivnog ploda u senzibilizirane trudnice provodi se danas temeljem anamnestičkih podataka, određivanjem visine i dinamike titra anti D antitijela, spektrofotometrijskim određivanjem količine bilirubina ili tzv. delta ekstinkcije bilirubina (ΔE450nm) iz uzoraka plodove vode, Dopplerskim mjerenjem maksimalne brzine struje krvi u središnjoj moždanoj arteriji fetusa i izravnim određivanjem krvne slike i stupnja fetalne anemije iz krvi umbilikalne vene. Druge antenatalne prognostičke metode nisu se pokazale korisnima u procjeni fetalne ugroženosti i perinatalnoga ishoda.
Kad se postavi dijagnoza RhD senzibilizacije, poželjno je zatražiti očev Rh fenotip ili Rh genotip. Otkrije li se da je otac homozigot za D antigen (D/D), sva njegova djeca bit će Rh pozitivna i potencijalno ugrožena od RhD senzibilizirane majke. No, ako je otac samo heterozigot (D/d), polovica potomstva bit će Rh negativna i samim tim sigurna od oštećenja anti D antitijelima prisutnima u krvotoku majke. U takvim slučajevima korisno je određivanje krvne grupe i Rh faktora ploda još tijekom trudnoće iz uzorka majčine krvi (nestanična fetalna DNK; engl. cell-free fetal DNA), uzorka plodove vode amniocentezom ili kordocentezom iz umbilikalne krvi.
Rizik od fetalne ugroženosti i potreba za amniocentezom procjenjuju se temeljem pripadnosti trudnice jednoj od četiri anamnestičke skupine trudnica (AST). U prvu AST spadaju slučajevi trudnoća u kojima je došlo do primoimunizacije fetalnim RhD antigenom, pa je to klinički najlakša skupina trudnoća u kojima plod u pravilu nije ugrožen. Izuzetak čine slučajevi primoimunizacije transfuzijom RhD pozitivne krvi Rh negativnoj trudnici, koji se tada moraju svrstati u četvrtu, najtežu skupinu trudnoća. Ostale tri skupine uzimaju u obzir tijek i ishod ranijih trudnoća s Rh senzibilizacijom. Tako se u drugu AST svrstavaju slučajevi trudnoća kojima su prethodile trudnoće s Rh senzibilizacijom završene u terminu i bez ijedne specifične medicinske intervencije u ranom neonatalnom razdoblju. U klinički težu treću AST ubrajaju se trudnoće kojima je prethodila terminska trudnoća (37 tjedana) s fetalnom hemolitičkom bolesti zbog koje se liječilo novorođenče s povišenim serumskim vrijednostima bilirubina. U četvrtu i klinički najtežu AST spadaju trudnoće nakon prethodne trudnoće u kojoj se hemolitička bolest razvila prije navršenog 37. tjedna trudnoće i koja je rezultirala mrtvorođenjem ili jatrogenim prijevremenim porodom i liječenjem nedonoščeta specifičnim metodama liječenja, uključujući eksangvinotransfuziju. U istu skupinu trebalo bi svrstati i trudnoće, ako su u prethodnoj trudnoći s Rh senzibilizacijom bile poduzete invazivne mjere liječenja (intrauterina ili intravaskularna transfuzija).
Premda se prijelaz fetalne krvi odnosno eritrocita kroz placentarnu membranu i vjerojatnost senzibilizacije ne mogu pouzdano kvantificirati u pojedinačnom slučaju, neki čimbenici koji utječu na spomenute procese, poznati su već dugo vremena. Tako se kod inkompatibilnosti ABO sustava krvnih grupa između majke i ploda Rh senzibilizacija pojavljuje rjeđe (kod prvorotki u 1,3% slučajeva, a kod višerotki u 1,1% slučajeva) nego kod ABO kompatibilnosti (u prvorotki u 4,5% slučajeva, a kod višerotki u 8,5% slučajeva). Može se zaključiti da inkompatibilnost krvnih grupa između majke i ploda pruža određenu zaštitu, ali se ova činjenica ne smije koristiti u praksi za pokušaje smanjenja pojave Rh senzibilizacije, jer nije dovoljno sigurna. Naime, ABO inkompatibilnost postoji u približno 20% trudnoća, a krvna grupa fetusa najčešće i nije poznata. Na vjerojatnost Rh senzibilizacije može utjecati i tzv. fenomen imunotolerancije prema kojem su neke žene više, a neke manje osjetljive na fetalne Rh antigene, pa tako mogu lakše ili teže stvarati specifična antitijela.
Dokažu li se anti RhD antitijela (pozitivan indirektni Coombs test) kod prve serološke pretrage (primarna senzibilizacija), njihov titar treba kontrolirati u slanoj fiziološkoj otopini u vremenskim intervalima od 3-4 tjedna ovisno o visini i dinamici titra. Uobičajeno je za graničnu vrijednost titra smatrati titar anti D antitijela 1:16 (ili 1:32), kada treba biti na oprezu, iako sama visina titra ima tek relativnu prognostičku vrijednost u procjeni fetalne ugroženosti i perinatalnog ishoda. Fetus tako može biti akutno ugrožen i kod niskih titrova (1:16), a može ostati neoštećen i kod viših vrijednosti titra specifičnih antitijela. Titar anti D antitijela u trudnoći obično (po)raste, a rjeđe stagnira, što ukazuje na mogućnost da majka nosi Rh negativno čedo i to isključivo u slučajevima očeve Rh heterozigotnosti za RhD antigen. Porast titra antitijela najčešće uzrokuje ponovna stimulacija specifičnim fetalnim D antigenom, što se naziva booster efektom, kad se obično nalaze brža dinamika porasta titra i značajnije povišene apsolutne vrijednosti. U spomenutim slučajevima bit će potrebno kontrolirati titar u dvotjednim intervalima, te pobliže provjeriti ugroženost ploda dodatnim dijagnostičkim metodama od kojih su neke invazivne. Visinu titra antitijela treba obvezno odrediti nakon svakog invazivnog intrauterinog zahvata. Porast titra, međutim, mogu uzrokovati i nespecifični podražaji drugih antigena različitih od RhD antigena, čije je prisustvo u trudnoći relativno često i uobičajeno. Opisana imunološka reakcija, tzv. anamnestička reakcija, javlja se u 3-5% slučajeva, a spomenuti porast titra anti D antitijela obično je blaži i nije opasan zbog činjenice da se radi o trudnoćama s Rh negativnim fetusom. Osim spomenutih visine i dinamike titra antitijela u majčinom krvotoku, na ugroženost fetusa utječu još i opsežnost prijelaza antitijela u fetalni organizam i trajanje ekspozicije odnosno izloženosti fetusa spomenutim antitijelima, što se ne može ni približno procijeniti, a kamoli izmjeriti. To potvrđuju slučajevi fetalne hemolize i anemije kod niskih titrova specifičnih antitijela i odsustvo karakterističnih kliničkih znakova fetalne bolesti kod vrijednosti titra znatno povišenih iznad granične vrijednosti.
U fiziološkim uvjetima koncentracije bilirubina kao produkta razgradnje fetalnih eritrocita rastu u fetalnom organizmu i plodovoj vodi do 18. tjedna trudnoće, zbog čega je boja plodove vode u prvoj polovici trudnoće žućkasta. Prema kraju trudnoće njegove se koncentracije konstantno smanjuju. Bilirubin prolazi transplacentarno i metabolizira se u majčinom organizmu. U slučajevima pojačane imunološke razgradnje fetalnih eritrocita bilirubinske frakcije (nekonjugirani i konjugirani bilirubin) nakupljaju se u plodovoj vodi kroz umbilikalne i korijalne krvne žile, filtracijom kroz bubrežne glomerule i derivacijom plućne tekućine kroz traheju fetusa. Koncentracije bilirubina u plodovoj vodi ovisne su o stupnju hemolize i posredno ukazuju na jačinu fetalne anemije. Treba naglasiti da biokemijsko određivanje bilirubina nije praktično zbog vrlo niskih vrijednosti u plodovoj vodi. Uzorci plodove vode za analizu uzimaju se transabdominalnom amniocentezom (punkcijom i aspiracijom plodove vode) čije se indikacije i vrijeme izvedbe planiraju temeljem visine procijenjenog rizika od fetalne ugroženosti. Najveći rizik nose pripadnost trećoj i četvrtoj AST, visok titar i brza dinamika porasta titra anti D antitijela, pa se u tim slučajevima preporučuje izvršiti amniocentezu i procijeniti stanje ploda već u kasnom drugom tromjesečju trudnoće, kako bi se spriječio nepovoljan perinatalni ishod. Prema nekim autorima, međutim, jedina sigurna metoda za određivanje stupnja hemolize u drugom tromjesečju trudnoće je iz uzorka umbilikalne venske krvi (Herrmann 1989).
Uzorak plodove vode (<10mL) za spektrofotometrijsku analizu mora biti primjeren, tj. voda mora biti bistra, a nikako krvava ili mekonijska, jer bi takav uzorak zbog (oksi)hemoglobina iz krvi odnosno mekonijskog bilirubina, biliverdina i koproporfirina bio dijagnostički neuporabljiv. Osim toga, uzorak plodove vode mora biti svjež i čuvan u tamnim epruvetama na 40C do analize. Za analizu je potreban precizan spektrofotometar i kivete optičke debljine 1cm. Najprije se odredi tzv. polazna apsorpcijska krivulja mjerenjem optičkih gustoća kod valnih duljina 350nm i 550nm, budući bilirubin kod spomenutih valnih duljina ne utječe na optičku gustoću analiziranog uzorka. Spajanjem dviju točaka u koordinatnom sustavu, koje odgovaraju vrijednostima optičke gustoće plodove vode kod 350nm i 550nm, dobije se praktično ravna apsorpcijska krivulja odnosno pravac. Zatim se mjere optičke gustoće plodove vode između navedenih valnih duljina u razmacima od 10-15nm i sve se dobivene vrijednosti unose u koordinatni sustav. Tako nastaje karakteristična apsorpcijska krivulja testiranog uzorka plodove vode koja sadržava bilirubin, čija se vršna vrijednost odnosno apsorpcijski maksimum karakterističan za bilirubin nalazi kod valne duljine 450nm. U perinatološkoj praksi se za detekciju povećanih količina bilirubina u plodovoj vodi, kao posrednom indikatoru fetalne anemije, koristi mjerenje razlike optičkih gustoća kod 450nm između polazne apsorpcijske krivulje i apsorpcijske krivulje testiranog uzorka plodove vode. Ta se razlika ili promjena optičke gustoće naziva delta ekstinkcija bilirubina i označava kao ΔE450nm (engl. optical density difference).
Liley AW se prvi počeo koristiti vrijednostima ΔE450nm za procjenu težine fetalne anemije, a svoj poznati pionirski rad objavio je još 1961. godine. U njemu je predstavio svoju empirijsku shemu, zapravo već spomenuti koordinatni sustav podijeljen u tri (A, B i C) odnosno četiri polja (B polje podijeljeno na B1 i B2), u koji se unose vrijednosti ΔE450nm (navedene na ordinati) u odnosu na odgovarajuću gestacijsku dob (navedenu na apscisi). Granične vrijednosti ΔE450nm između pojedinih polja označene debljim crtama imaju „silazni“ smjer, što znači da njegova shema uvažava činjenicu smanjivanja koncentracija bilirubina prema kraju trudnoće. Vrijednosti ΔE450nm u polju A označavaju najlakšu fetalnu anemiju ili uredan nalaz uz mogućnost da se radi o Rh negativnom fetusu (otac mora biti heterozigot za D antigen). Analizu plodove vode može se ponoviti za 2-4 tjedna, pri čemu niske stagnirajuće ili padajuće vrijednosti ΔE450nm ukazuju na uredno stanje fetusa i dobru perinatalnu prognozu, najvjerojatnije, s porodom u terminu. Vrijednosti ΔE450nm koje pripadaju polju B, pouzdan su dokaz Rh senzibilizacije i znak određenog stupnja fetalne anemije. Amniocentezu i analizu plodove vode obično se preporuča ponoviti za 7-14 dana, a ovisno o početnim vrijednostima (polje B1 ili B2) i dinamici ΔE450nm (stagnacija, pad ili porast vrijednosti) treba očekivati porod donošenog čeda ili kasni prijevremeni porod (35-36 tjedana). Ukoliko vrijednosti ΔE450nm iz polja B „prelaze“ u polje C ili su početne vrijednosti već bile u polju C, treba računati s težim stupnjem fetalne anemije (vrijednosti hemoglobina <80g/L) i realnom ugroženosti ploda. Amniocentezu i određivanje ΔE450nm treba ponoviti nakon 24 sata i u slučaju potvrde nalaza odlučiti se za intrauterino liječenje ili dovršenje trudnoće ovisno od gestacijske dobi. Prema podatcima iz literature, 34 tjedna trudnoće najčešće se smatraju graničnom gestacijskom dobi za spomenutu opstetričku odluku, iako se u novije vrijeme navodi da je s poboljšanim uvjetima i mogućnostima neonatološke službe ta gestacijska dob postignuta već s 32 tjedna trudnoće. Opisana dijagnostička metoda za procjenu stupnja hemolize i fetalne anemije prema vrijednostima ΔE450nm u plodovoj vodi pokazala se vrlo dobrom u opstetričkoj praksi, osobito za trudnoće trećeg tromjesečja. Osjetljivost metode procjenjuje se na 95%, a detekcijska učinkovitost na 85-95% za rezultate ΔE450nm odnosno procjene stupnja fetalne anemije, koji pripadaju poljima B2 i C.
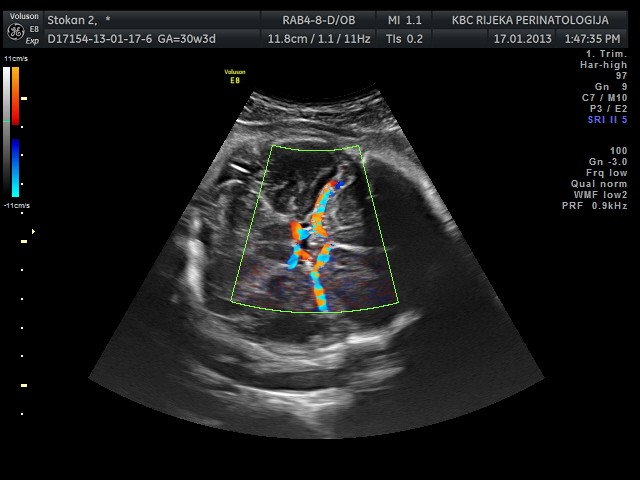
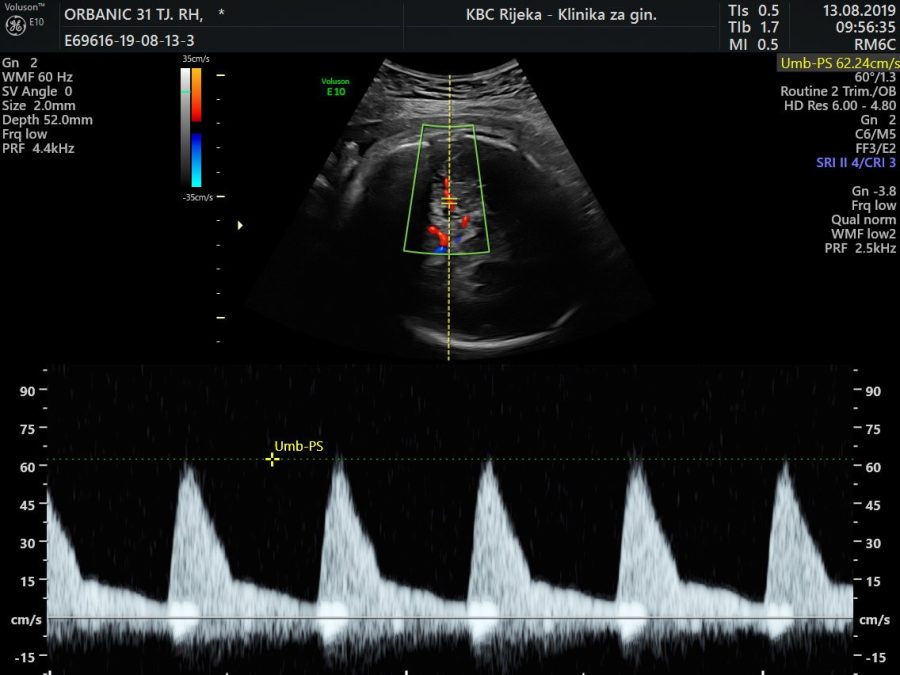
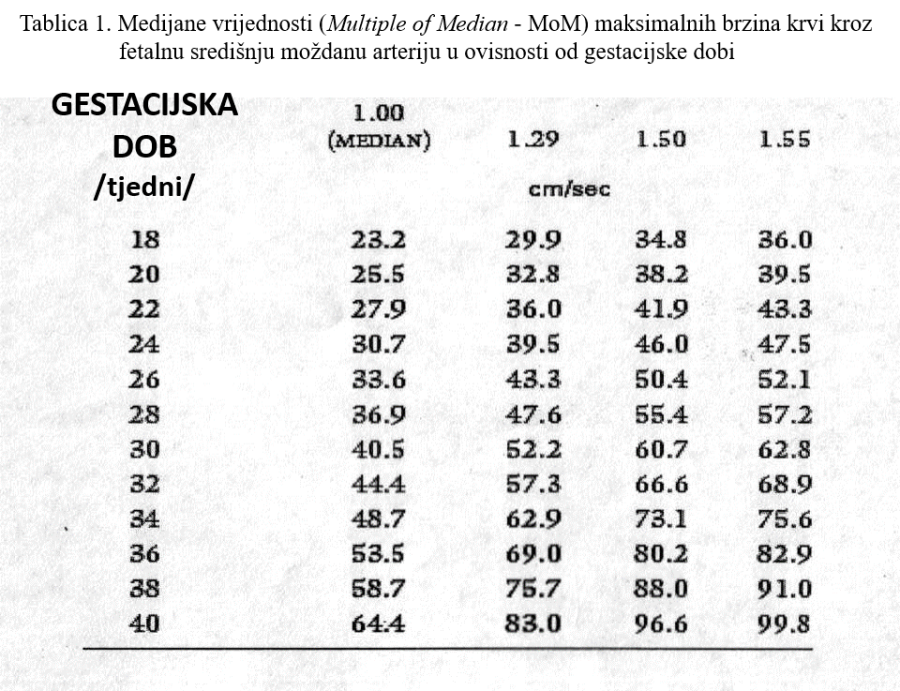
Još osamdesetih godina prošloga stoljeća ustanovljena je komplementarna antenatalna metoda Dopplerskog mjerenja brzine strujanja krvi kroz fetalnu središnju moždanu arteriju, koja je omogućila pouzdanu neinvazivnu procjenu stupnja fetalne anemije, a temelji se na pozitivnoj korelaciji između navedenih parametara. Naime, s pojačanjem stupnja hemolize i anemije smanjuje se viskoznost fetalne krvi pa su brzine strujanja krvi u moždanoj arteriji sve veće. Inače, brzine strujanja krvi fiziološki rastu tijekom trudnoće i najveće su u terminskoj trudnoći. Na fetalnu anemiju može se posumnjati kad izmjerene maksimalne brzine krvne struje kroz proksimalni (početni) segment središnje moždane arterije (Slike 1 i 2) prelaze vrijednosti od 1,5 medijane (MoM) za određenu gestacijsku dob (Tablica 1).
Za određivanje stupnja hemolize i anemije iz krvi umbilikalne vene mogu se koristiti uzorci krvi od 1-2mL, koji se dobivaju kordocentezom poslije 22. tjedna trudnoće. Izravno određivanje fetalne krvne slike, vrijednosti bilirubina i anti D antitijela (direktan Coombs test) iz uzoraka umbilikalne krvi znakovito je najpouzdanija metoda za procjenu fetalne ugroženosti u kasnom drugom tromjesečju trudnoće. Na ovaj način može se doći i do sigurnih podataka o krvnoj grupi i Rh faktoru fetusa. Glavni nedostatak spomenutog postupka, kao posljedica njegove invazivnosti, su potencijalne i po život opasne komplikacije za fetus (hidroreja, bradikardija, krvarenje, smrt), pa se za njegovu kliničku primjenu i izvedbu traže stručna osposobljenost i specifično iskustvo, koji postoje samo u nekim perinatološkim centrima.
Metode liječenja i opstetrički postupci tijekom poroda
Rh-senzibilizacija je stečeno, ali definitivno stanje, budući jednom stvorena anti Rh antitijela ostaju doživotno u senzibiliziranom majčinom organizmu. Drugim riječima, ne postoji niti jedan poznati medicinski postupak ili učinkovita metoda za potpunu eliminaciju antitijela odnosno desenzibilizaciju već senzibiliziranih žena, pa se od liječenja ne može očekivati izlječenje, već samo potencijalno smanjenje fetalne ugroženosti. Od medikamentoznih imunosupresivnih metoda učinkovitijom od ostalih pokazala se peroralna primjena kortikosteroida (npr. Pronison, Decortin) tijekom trudnoće s ciljem kontrole stvaranja anti D antitijela u smislu sekundarne prevencije. Obično se preporučuje uzimati 3 x 10mg ovoga lijeka dnevno. Prednost pronisona je da ne prolazi placentarnu barijeru i ne dospijeva u fetalni organizam, pa je njegovo davanje u trudnoći dovoljno sigurno. Njegova primjena je rezervirana za treću i četvrtu “anamnestičku” skupinu trudnica s najtežim ishodima u prethodnim trudnoćama, a praksa je pokazala da može umanjiti rizik u aktualnoj trudnoći i poboljšati neonatalni ishod. Učinkovitost djelovanja lijeka prati se kontrolom dinamike titra specifičnih antitijela. Od plazmafereze, invazivnog medicinskog postupka izmjene velikih količina plazme, može se očekivati odstranjenje antitijela iz krvotoka trudnice, ali metoda je komplicirana i potencijalno opasna u trudnoći pa nije zaživjela u rutinskoj praksi. Različite metode hipo- i desenzibilizacije trudnice nisu također polučile zadovoljavajuće rezultate. Zato se u slučajevima procijenjene fetalne ugroženosti treba odlučiti liječiti fetus ili dovršiti trudnoću pa liječiti novorođenče.
Kada se radi o niskoj gestacijskoj dobi između 24. i 32. tjedna trudnoće i velikoj opasnosti od neonatalnih komplikacija nezrelosti, uključujući i ranu neonatalnu smrt, poželjno je liječenje započeti već intrauterino. Takvo liječenje “in utero” podrazumijeva intraabdominalnu i/ili intravaskularnu fetalnu transfuziju ozračene „O“ ili kompatibilne Rh-negativne krvi u dozi koja se prethodno izračuna temeljem podataka o fetalnoj masi i koncentraciji hemoglobina u fetalnoj krvi. Intraabdominalna transfuzija se sastoji u aplikaciji Rh negativnih eritrocita u fetalnu peritonealnu šupljinu, odakle se resorbiraju u krvotok. Prvu takvu intrauterinu transfuziju pod rtg kontrolom izveo je Liley još 1961. godine, a zahvat se već dugo izvodi pod ultrazvučnom kontrolom. Kod intravaskularne transfuzije krv se injicira izravno u umbilikalnu venu i fetalni krvotok, zbog čega su klinički rezultati značajno bolji primjenom ove vrste transfuzije, osobito u slučajevima fetalnog hidropsa. Opisanim invazivnim postupcima popravlja se fetalna anemija i omogućuje produženje trudnoće, čime rastu izgledi za fetalno odnosno neonatalno preživljavanje. Ponekad će zahvat biti potrebno ponavljati ovisno o težini poremećaja i nalazima krvne slike nakon transfuzije.
Najučinkovitije „liječenje“ Rh senzibilizacijom uzrokovane teške fetalne anemije je jatrogeni završetak trudnoće, prijevremeno ili u terminu, a o načinu dovršenja trudnoće odlučuje opstetričar ovisno o konkretnim opstetričkim podatcima (anamnestički podatci, gestacijska dob, lokalni nalaz, dodatni gestacijski komorbiditet, znakovi akutne fetalne patnje, …). Može se zaključno reći da vaginalnom porodu treba dati prednost pred elektivnim carskim rezom, kad god za vaginalni porod postoje povoljni uvjeti. Drugim riječima, slučajevi Rh senzibilizacije nisu sami po sebi indikacija za elektivni carski rez, već za tu odluku trebaju postojati i dodatni razlozi koji onemogućuju, značajno otežavaju ili bi mogli kompromitirati vaginalni porod ili ugroziti život majke ili čeda. Tijekom poroda stanje fetusa treba pratiti kardiotokografski i prema potrebi mikroanalizama fetalne krvi koje omogućuju kontrolu acidobaznog statusa i krvne slike. Postupcima u porodu treba smanjiti mogućnosti prijelaza fetalne krvi (eritrocitnih antigena) u majčin krvotok, ali i obratno. Neposredno nakon poroda treba zato brzo podvezati pupkovinu i tako sprječiti daljnji prijelaz majčinih anti D antitijela, ali i izbjegavati traumatizirajuće zahvate na uterusu kad god je to moguće. Poželjno je da porodima Rh senzibiliziranih rodilja s nalazima E450nm u poljima B2 i C Liley-eve sheme prisustvuje neonatolog, kako bi u slučaju potrebe započeo s odgovarajućim postupcima neonatološke intenzivne skrbi. Prvi uzorci krvi za određivanje KG, Rh faktora, KKS i koncentracije bilirubina uzimaju se iz umbilikalne vene. Kod povišenih serumskih vrijednosti bilirubina iznad graničnih, anemije i pozitivnog direktnog Coombs testa potrebno je primijeniti postupke za sniženje koncentracije bilirubina (lijekovi, fototerapija, eksangvinotransfuzija), a po potrebi i transfuziju kompatibilne krvi uz redovite kontrole krvnih nalaza.
Neonatalna hemolitička bolest
Neonatalna hemolitička bolest se može manifestirati u tri klinička oblika, od klinički najlakšeg (novorođenačka anemija; lat. anaemia neonatorum), preko težeg (novorođenačka žutica; lat. icterus gravis neonatorum) do klinički najtežeg oblika (univerzalni hidrops; lat. hydrops congenitus universalis). Novorođenačka anemija zbog hemolize rijetko zahtjeva liječenje nadoknadom kompatibilne krvi, a potrebno je dokazati da je hemoliza uzrokovana anti Rh antitijelima (pozitivan direktni Coombs test). Teška novorođenačka žutica je nefiziološka žutica odnosno hiperbilirubinemija koja se razvija vrlo rano, unutar 24 sata od poroda, zbog nemogućnosti nedovoljno zrele jetre da preradi (konjugira) povećane količine indirektnog bilirubina nastalog kao posljedica pojačane imunološke hemolize. Budući se indirektni bilirubin ne može izlučivati urinom, nagomilava se u krvotoku i moždanim jezgrama, pa ako se stanje ne liječi, može uzrokovati trajno hipoksično oštećenje moždanih stanica poznato kao bilirubinska encefalopatija ili kernkterus koji karakteriziraju mentalna retardacija, konvulzije, gluhoća i dr. Univerzalni hidrops koji se najčešće razvije još prenatalno, karakteriziraju generalizirani edemi tkiva, hepatosplenomegalija, nakupljanje slobodne tekućine u tjelesnim šupljinama (ascites, …), hipoproteinemija i poremećaji elektrolita. Opisani klinički oblik je najteži za liječenje i rezultira visokom smrtnošću, ali je srećom izvanredno rijedak.
Prevencija (profilaksa) Rh senzibilizacije
Profilaksa ili primarna prevencija Rh-senzibilizacije od presudne je važnosti za smanjenje incidencije ovog patološkog stanja i perinatalnog mortaliteta. Ona se provodi sa svrhom sprječavanja primarne imunizacije odnosno primarnog imunološkog odgovora u Rh negativnih žena i postoji samo za senzibilizaciju RhD antigenom koji je ujedno i najprisutniji (≤95% slučajeva). Eksperimentiranje s postupcima profilakse datira još iz 60-tih godina prošloga stoljeća, dok se prva klinička uporaba spominje 1964. godine (New York, Liverpool, Freiburg). Samo tri godine kasnije spomenuti je medicinski postupak primijenjen i kod nas u Rijeci.
Profilaksu treba primijeniti što prije nakon predmnijevane fetomaternalne transfuzije, najkasnije u roku od 72 sata, kod svih RhD negativnih i nesenzibiliziranih žena nakon poroda koje nose RhD pozitivan plod odnosno kod onih koje se nađu u kliničkim situacijama povišenoga rizika za Rh-senzibilizaciju, kao što su pobačaji, invazivni intrauterini zahvati tijekom trudnoće ili izraženije intrauterino krvarenje u trudnoći, a RhD status ploda nije poznat. Količina transfundirane fetalne krvi ovisi o načinu poroda i eventualnim opstetričkim intervencijama, pa je tako veća kod carskoga reza, manualne lize posteljice i instrumentalne eksploracije uterusa u odnosu na uredan vaginalni porod bez opstetričkih operacija. Najmanja količina fetalne krvi potrebna za primarnu imunizaciju majke iznosi 0,05mL (0,01‰ fetalnih eritrocita). Profilaksa se sastoji od intramuskularne (i.m.) aplikacije anti RhD imunoglobulina (IgG anti D), najčešće u standardiziranoj dozi od 250-350μg ili eventualno intravenske (i.v.) u manjoj dozi od 125-150μg IgG anti D. Na mjestu primjene anti D (Rh) imunoglobulina postoji rijetka mogućnost lokalnih reakcija i febriliteta. Budući 20-25μg IgG anti D injiciranih i.m. “pokriva” jedan mililitar (mL) RhD pozitivne fetalne krvi, spomenute doze za pasivnu imunizaciju su dovoljne za uobičajene fetomaternalne transfuzije do 10mL. Rijetke su tzv. makrotransfuzije >10mL (u 1-4‰ slučajeva) kada su potrebni preparati koji sadrže više od 250 IgG anti D. Za vrlo rijetke slučajeve makrotransfuzije od >30mL fetalne krvi najbolje je udvostručiti dozu injiciranih anti RhD imunoglobulina. Profilaksu treba provesti nakon svakog poroda RhD pozitivnog čeda (ili pobačaja) uz prethodni dokaz negativnih anti D antitijela u majke (negativan indirektni Coombs test), jer nema smisla dati anti D imunoglobulinske preparate već Rh senzibiliziranim ženama. Zbog minimalnoga rizika od prijelaza dovoljne količine fetalne krvi u majčin krvotok tijekom trudnoće, tj. rizika od primarne imunizacije, samo su rijetke zemlje uvele RhD profilaksu i tijekom trudnoće u obliku jedne ili dvije doze IgG anti D. Imunoglobulini anti D aplicirani pasivnom imunizacijom u majčin organizam sprječavaju primarnu RhD imunizaciju odnosno primarni imunološki odgovor na način da se najprije povežu s D antigenima fetalnih eritrocita koje zatim vrlo brzo fagocitiraju makrofagi. Nakon toga slijedi jednako tako brza razgradnja i eliminacija antigena, prije nego što se strani fetalni D antigeni uspiju prezentirati imunološkom sustavu (B limfocitima) majke. Aplicirana anti D antitijela zadržavaju se u organizmu majke najviše do tri mjeseca i ne mogu nikako ugroziti plod u sljedećoj trudnoći. Uspješnost redovite i dobro indicirane primjene profilaktičkoga postupka vrlo je visoka i rezultira vrlo niskom pojavnosti Rh senzibilizacije s oko 1-2 slučaja na 1000 poroda. Vrlo rijetki slučajevi neuspješne profilakse najčešće se otkrivaju dokazom anti D antitijela u sljedećoj trudnoći, a posljedica su fetomaternalnih makrotransfuzija ili pogrešne aplikacije IgG anti D ženama u čijem je organizmu već od ranije pokrenut mehanizam primarnog imunološkog odgovora.
Za sprječavanje RhD senzibilizacije zbog makrotransfuzije na raspolaganju su metoda brojenja fetalnih eritrocita u perifernoj krvi majke i postupak određivanja slobodnih IgG anti D antitijela nakon aplikacije preparata s anti D imunoglobulinom. Brojenje fetalnih eritrocita u perifernoj krvi majke za procjenu volumena transfundirane fetalne krvi omogućuje Kleihauer-Betke-ov test (1957). Radi se o eluacijskoj metodi kojom se otapa i ispiranjem odstranjuje adultni hemoglobin iz majčinih eritrocita pa zaostaju tzv. stanice „duhovi“ (engl. ghost cells), dok rezistentni i crvenkasto obojeni fetalni hemoglobin (HbF) ostaje u fetalnim eritrocitima i markira ih, što omogućuje njihovo jednostavno brojenje pomoću mikroskopa. Premda postoje složenije i preciznije formule za procjenu volumena transfundirane fetalne krvi, ovaj se može procijeniti sljedećom pojednostavljenom i praktičnijom formulom (legenda: V procijenjeni volumen fetalne krvi, FE fetalni eritrociti, UE ukupan broj (fetalnih i majčinih) eritrocita u vidnim poljima mikroskopa):
broj FE
V = ————– x 50 [mL]
1000 UE
Postupak određivanja slobodnih IgG anti D antitijela u organizmu majke nakon aplikacije preparata s anti D imunoglobulinom temelji se na dokazu slobodnih antitijela 24 sata nakon aplikacije standardiziranog preparata s anti D imunoglobulinom. Njihovo prisustvo u majčinom krvotoku znači klinički uspješnu imunoprofilaksu, jer su ostala „potrošena“ vezivanjem na fetalne D antigene. Kada se, međutim, slobodna antitijela ne mogu dokazati, treba pretpostaviti da je u krvotoku majke ostalo još nevezanih fetalnih D antigena koji bi mogli uzrokovati primoimunizaciju, pa je u tim slučajevima potrebno injicirati još jednu dodatnu dozu anti D imunoglobulina.
Izoimunizacija krvnim (ABO) i drugim antigenskim grupama
U konstelacijama majki s krvnom grupom O i njihove djece s krvnim grupama A i B mogu se tijekom trudnoće razviti u majčinom organizmu anti A i/ili anti B antitijela (hemolizini) u visokim titrovima. Najčešći su slučajevi konstelacija majki i djece s krvnim grupama O i A (oko 90%), rijetki su s krvnim grupama O i B (<10%), dok su slučajevi s krvnim grupama majki A ili B i njihove djece s nepodudarnim krvnim grupama B/AB ili A/AB vrlo rijetki.
Imunološka zbivanja kod ovog poremećaja u principu su vrlo slična imunološkim reakcijama kod Rh hemolitičke bolesti. Međutim, zbog drugačijih osobina antigena A i B u odnosu na Rh antigene, na njih stvorena majčina anti A i anti B antitijela, iako su inkompletna i prolaze transplacentarno, ne predstavljaju prenatalno opasnost za plod, jer jednostavno ne razgrađuju fetalne eritrocite. Otkriju li se takvi slučajevi prenatalno, samo se registriraju, ali ne mijenjaju opstetričke principe nadzora i dovršenja trudnoće i poroda. Budući vrijednosti titra anti A i anti B antitijela u krvi majke ne koreliraju sa stupnjem ugroženosti novorođenčeta, neposredno nakon poroda treba pratiti koncentracije bilirubina u umbilikalnoj krvi i kasnije kod novorođenčeta, da bi se u slučaju njihovih kritičnih vrijednosti moglo sprovesti odgovarajuće liječenje lijekovima, fototerapijom ili eksangvinotransfuzijom.
Na fetalnim eritrocitima otkriveno je preko pedesetak različitih antigena. Imunološki uzrokovanu fetalnu anemiju mogu izazvati i antitijela na druge (iregularne) eritrocitne antigenske sustave, kao što su npr. Kell (K) i Duffy (Fy) antigeni, pod uvjetom da su spomenuti antigeni strani majčinom organizmu. Klinička slika, dijagnostičke i terapijske metode ne razlikuju se od slučajeva Rh senzibilizacije, ali za spomenute kliničke situacije ne postoji mogućnost profilakse. Osim toga, potencijalno opasna senzibilizacija na Kell antigen ugrožava plod patogenetskim mehanizmom različitim od hemolitičke anemije. Naime, anti K antitijela prolaze transplacentarno, vezuju se za K antigene nezrelih eritroblasta u fetalnoj koštanoj srži i sprječavaju proces njihovog sazrijevanja do zrelih formi eritrocita. Rezultat je različit stupanj fetalne anemije sa svim kliničkim posljedicama koje su opisane kod Rh senzibilizacije. S druge strane, antitijela na druge eritrocitne antigene poput anti Duffy (Fy), anti Kidd (Jka, Jkb), anti Lewis (Le), anti Wright (Wr), anti M, anti P, anti S i sl., najčešće nisu klinički značajna, jer vrlo rijetko ili nikako ne uzrokuju fetalnu hemolitičku bolest odnosno anemiju.